Todos, tanto los profesionales como los pacientes, comprenden que las técnicas de reproducción asistida (TRA) no siempre tienen éxito debido a las imperfecciones técnicas y las limitaciones de la reproducción humana.
Ante los repetidos fracasos de las TRA, los médicos deben intentar determinar si la causa es un problema que reside en el embrión o en el endometrio.
Aunque es más fácil decirlo que hacerlo.
El debate sobre la definición del fallo de implantación recurrente (FIR) se ha incrementado con parámetros más estrictos utilizados a medida que los resultados del tratamiento van mejorando. A pesar de las numerosas publicaciones sobre el FIR, sigue siendo una de las áreas más enigmáticas de la terapia antirretroviral sin una definición universal. Hasta ahora, ninguna sociedad médica ha asumido el reto de sugerir una definición del FIR o de indicar qué medidas deben adoptarse en caso de fracasos repetidos del tratamiento.
El parámetro más utilizado para definir el FIR ha sido el número de embriones transferidos con resultado fallido. Los primeros investigadores propusieron que el FIR se definiera como el fracaso de la TRA tras la transferencia de al menos 10 embriones. Más recientemente, con el reflejo de los avances en biología reproductiva, han entrado en la ecuación otras definiciones más conservadoras. En efecto, se declara que existe un FIR después de al menos cuatro transferencias fallidas de embriones de buena calidad.(1)
Por razones obvias, los fracasos de los ciclos de FIV pueden deberse a uno o varios factores, y no necesariamente al mismo factor o factores cada vez.
Muchas mujeres con fracasos repetidos de TRA tienen embriones cromosómicamente anormales o aneuploides. Sin embargo, hoy en día, el principal error genético que afecta a los embriones (la aneuploidía de los cromosomas completos) puede tenerse en cuenta mediante la realización de un PGT-A. Por lo tanto, cuando se realiza un PGT-A, los embriones genéticamente anormales no se transfieren y, por lo tanto, dejan de formar parte de la población FIR. Aunque las tasas de implantación de los embriones euploides mejoran notablemente en comparación con los embriones no analizados, no todos los embriones euploides se implantan. La edad materna tiene su efecto, aunque reducido, en las tasas de implantación de los embriones euploides a partir de los 33 años, según informes recientes del grupo IVIRMA. (2)
Con el advenimiento de la era genérica, se han desplegado esfuerzos reales para definir los cambios endometriales vinculados a la ventana de implantación (“WOI”, por sus siglas en inglés) según la expresión de varios genes clave en el endometrio. En particular, los investigadores propusieron la prueba de análisis de receptividad endometrial (o test ERA) para evaluar la calidad de la receptividad endometrial y el avance de los cambios endometriales. (3) Se han propuesto otras pruebas de receptividad, en particular, basadas en la expresión de 11 genes seleccionados por su papel en el control de la receptividad endometrial o los perfiles de miARN. (4) Aunque son de gran interés, estos enfoques aún no han sido validados en ECA formales. Revisando la evaluación de la receptividad endometrial, otras investigaciones subrayan el papel de la expresión de la proteína BCL6 en el endometrio y la resistencia a la progesterona en mujeres con endometriosis como predictores de una mala implantación (5). El reciente informe sobre las tasas de implantación inalteradas tras las transferencias de blastocitos euploides congelados en la endometriosis indica que estos efectos perjudiciales de la endometriosis parecen neutralizarse en los ciclos de E2 y progesterona utilizados para las FET (o transferencias de embriones congelados). Un grupo francés llevó a cabo otra estrategia, intentando determinar un perfil inmunológico endometrial ideal que optimizara notablemente las tasas de implantación en la FET. (6) También en este caso, la teoría es interesante, pero el enfoque no ha sido validado en un ECA formal.
A la luz de lo anteriormente indicado, consideramos que el fracaso de al menos tres transferencias consecutivas de blastocitos congelados euploides únicos en mujeres con úteros morfológicamente normales definiría razonablemente el FIR.
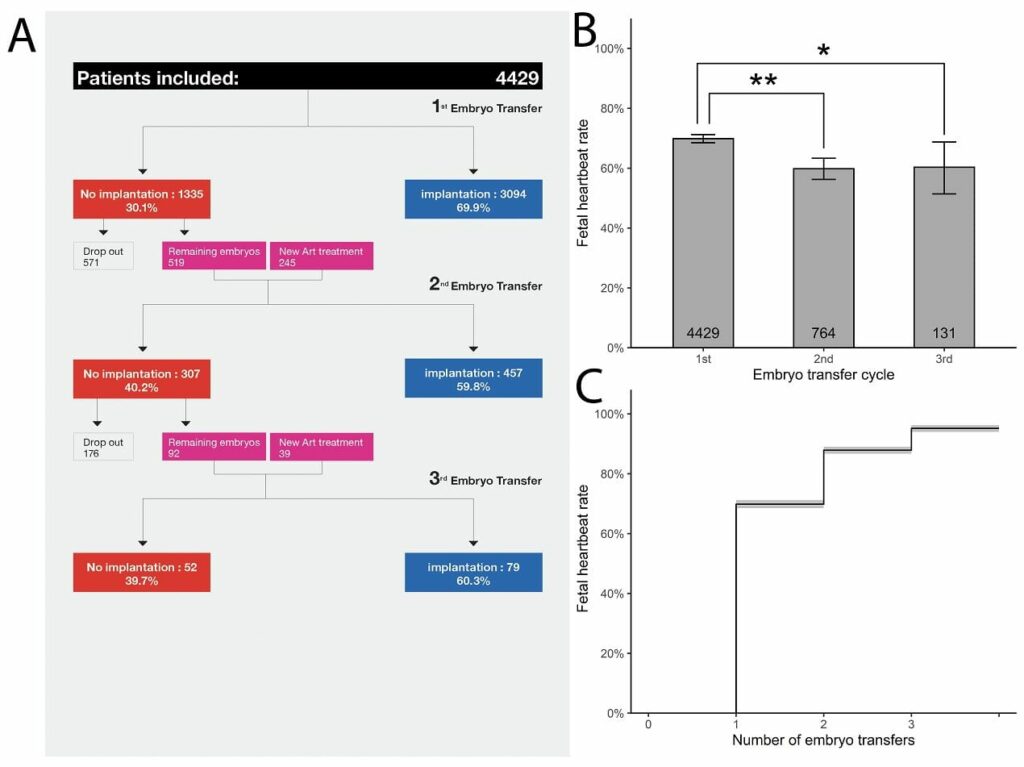
Esta es la razón por la que realizamos un gran estudio retrospectivo sobre todos los pacientes (en total 4429 pacientes) con hasta tres transferencias consecutivas de embriones congelados euploides simples entre enero de 2012 y julio de 2018 en IVIRMA New Jersey. Nuestros hallazgos sugieren que el verdadero FIR es poco frecuente. Para aquellos pacientes con la capacidad de lograr blastocistos euploides, el 95,2 % lograría un embarazo clínico con 3 embriones transferidos. (Fig. 1)
Tal y como demuestra este estudio, las tasas de implantación disminuyen mínimamente con el aumento de las transferencias, pero el hecho de que sigan siendo elevadas sugiere que el 5 % que no consigue implantar después de tres intentos puede ser en gran medida víctima de simples probabilidades/estadísticas y que las transferencias adicionales ofrecen la esperanza de un buen resultado. Nuestros resultados indican que las posibles causas endometriales del FIR son muy poco frecuentes, por lo que se ponen en duda todos los ensayos de receptividad endometrial, ninguno de los cuales ha demostrado su utilidad en los ECA.
En conclusión, los ensayos de receptividad endometrial disponibles en la actualidad pueden no ser útiles para el tratamiento de mujeres con FIR con un útero morfológicamente normal.
Puede ser razonable que la paciente se someta a otra transferencia de embriones congelados. La tendencia, tanto de la paciente como de los médicos, es querer cambiar algo ante el fracaso.
Estos datos sugieren que el simple hecho de mantener el rumbo ofrece una alta probabilidad de éxito.
- Coughlan C, Ledger W, Wang Q, Liu F, Demirol A, Gurgan T et al. Recurrent implantation failure: definition and management. Reprod Biomed Online 2014;28:14-38.
- Franasiak JM, Forman EJ, Hong KH, Werner MD, Upham KM, Treff NR et al. The nature of aneuploidy with increasing age of the female partner: a review of 15,169 consecutive trophectoderm biopsies evaluated with comprehensive chromosomal screening. Fertil Steril 2014;101:656-63.e1.
- Bassil R, Casper R, Samara N, Hsieh TB, Barzilay E, Orvieto R et al. Does the endometrial receptivity array really provide personalized embryo transfer? J Assist Reprod Genet 2018;35:1301-5.
- Neves AR, Devesa M, Martínez F, Garcia-Martinez S, Rodriguez I, Polyzos NP et al. What is the clinical impact of the endometrial receptivity array in PGT-A and oocyte donation cycles? J Assist Reprod Genet 2019;36:1901-8.
- Lessey BA, Young SL. What exactly is endometrial receptivity? Fertil Steril 2019;111:611-7.
- Lédée N, Petitbarat M, Prat-Ellenberg L, Dray G, Cassuto GN, Chevrier L et al. Endometrial Immune Profiling: A Method to Design Personalized Care in Assisted Reproductive Medicine. Frontiers in immunology 2020;11:1032.